EFECTO DE LA INTERACCIÓN DEPREDADOR/PRESA: COEVOLUCIÓN ENTRE THAMNOPHIS SIRTALIS Y TARICHA GRANULOSA


Artículo de Goirod & Rovi, para Tuatera.com. Este artículo ha sido cedido por sus autores para su uso y difusión únicamente en tuatera.com. Este artículo esta protegido por las leyes intelectuales y de derechos de autor. No obstante puedes utilizarlo en medios online NO IMPRESOS y siempre y cuando sea para fines sin ánimo de lucro, siempre que no se cambie, ni resuma, ni modifique en forma alguna su contenido y siempre que se haga referencia a esta dirección web www.tuatera.com y a sus autores, Goirod & Rovi. Las imágenes no son de los autores.
INTRODUCCIÓN
El proceso coevolutivo describe interacciones que implican adaptaciones evolutivas recíprocas entre dos especies, en las cuales un cambio en una de ellas actúa como fuerza selectiva en la segunda especie, y a su vez, la adaptación en esta segunda especie actuará como fuerza selectiva en la primera. (Rausher, 2001). Este proceso implica cambios genéticos en ambas especies. Sin embargo, las bases genéticas de la mayoría de los casos aún no han sido determinadas, y por tanto, con frecuencia es complicado discernir que cambios en una especie actúan como la fuerza selectiva que induce al cambio evolutivo en la otra. Uno de los procesos coevolutivos más estudiados, es la relación entre depredadores y presas (Simss, 1996). En este tipo de interacción, el depredador frecuentemente adquiere adaptaciones importantes como sistemas sensoriales muy desarrollados, garras y dentición especializa o venenos que les ayuden a capturar y consumir a sus presas (Hochberg & Van Baalen 1998). Por el lado contrario, en las presas han surgido adaptaciones como la producción de sustancias químicas que les permiten escapar y ahuyentar a sus depredadores.
Este es el caso de los anfibios cuyas glándulas epiteliales secretan sustancias con función defensiva (Duellman & Trueb, 1986), algunas de las cuales pueden llegar a ser letales. Sin embargo, muchas serpientes han desarrollado resistencia a las toxinas que matan a otros depredadores, como por ejemplo Heterodon y Xenodon que se alimentan de sapos del genero Bufo (Smith & White, 1955) o Liophis que se alimenta de ranas arlequín (Atelopus sp.) y de ranas flecha (Dendrobates y Phyllobates; Myers et al., 1978). De un modo similar, la serpiente jarretera (Thamnophis sirtalis) se alimenta de la salamandra granulosa (Taricha granulosa).

Taricha granulosa
Las salamandras del género Taricha poseen cantidades variables de tetrodoxina (TTX) en su piel y otros tejidos (Mosher et al., 1964). La TTX es una potente neurotoxina que se une a los canales de sodio de las células nerviosas y musculares bloqueando la propagación de los impulsos nerviosos (Hille, 1992; ver en Geffeney, et al. 2005). La toxicidad de Taricha varía entre las especies y poblaciones, pero algunos individuos de la especie T. granulosa poseen suficiente TTX como para matar de 10 a 15 personas (Brodie et al., 2002). La TTX en las concentraciones en las que aparece en T. granulosa es letal para todos sus depredadores conocidos salvo para Thamnophis sirtalis (Brodie et al., 2002). Los estudios filogenéticos sugieren que todas las especies del género Thamnophis poseen niveles variables de resistencia a la TTX, lo que predispone a este grupo a sufrir cambios fenotípicos en respuesta a esta toxina (Motychak et al., 1999). Sin embargo, y a pesar de esta predisposición, Thamnophis sirtalis es la única especie conocida que aparentemente a evolucionado junto con la toxicidad de su presa.
Se ha observado que tanto la toxicidad de las salamandras como la resistencia de las serpientes siguen un patrón geográfico.

Thamnophis sirtalis
De este modo, las poblaciones de T. sirtalis, que viven en lugares donde existen poblaciones de T. granulosa tóxicas, han desarrollado resistencia fisiológica a la TTX, y los niveles de resistencia generalmente covarían con la toxicidad de las salamandras a lo largo de su distribución (Brodie et al. 2002), dando como resultado una variabilidad geográfica en caracteres fisiológicos en la resistencia a la TTX en los linajes de Thamnophis.
La resistencia de las serpientes a esta neurotoxina viene de una alteración en la estructura de los canales de sodio que inhiben la unión de la TTX a dichos canales. Aunque quizás éste sea el factor más importante, la resistencia a la TTX es una mezcla de factores tanto fisiológicos, como comportamentales y morfológicos.
Dentro de T. sirtalis, la resistencia extrema a la TTX ha evolucionado al menos dos veces, y varia alrededor de tres órdenes de magnitud a lo largo de las diferentes poblaciones (Brodie et al., 2002; Janzen et al., 2002; Hanifin et al., 2008). Los patrones de distribución fenotípicos indican que existen dos áreas de máxima coevolución; una en California y otra en Oregón, rodeadas por áreas de menor coevolución. Se ha observado que en estas zonas existe una relación estrecha ente la defensa de la presa y la resistencia del depredador, sugiriendo que existe una selección reciproca entre ambas especies. Desafortunadamente, esta correlación entre fenotipos de depredador y presa es la evidencia más directa conocida de que existe una selección espacial (Brodie et al., 2002).
La coevolución entre Tamnophis sirtalis y la salamandra Taricha granulossa es un ejemplo clásico de coevolución entre depredador y presa, donde la resistencia de las serpientes, realiza una fuerza selectiva en el incremento de la toxicidad de las salamandras, las cuales a su vez ejercen presión sobre la resistencia de las serpientes a la TTX. Así, en este caso la coevolución es guiada por selección reciproca, que viene de interacciones ecológicas entre especies, las cuales están mediadas por caracteres específicos: la toxicidad de T. granulossa y la resistencia T. sirtalis.
VARIACIÓN GEOGRAFICA
La variación en los niveles de resistencia a la TTX presentados por las serpientes jarreteras, constituyen una evidencia de que la estructura geográfica es un componente importante para entender la interacción coevolutiva entre depredadores y presas.
En el caso de la interacción entre T. sirtalis y T. granulosa, tanto los niveles de resistencia del depredador como los niveles de toxicidad de la presa varían considerablemente entre poblaciones e incluso entre las que se encuentran separadas por pequeñas distancias (Fig. 2). Esta variación es consistente con dos áreas de intensa resistencia del depredador a la neurotoxina, rodeadas por zonas de resistencia decreciente (Fig. 2). Los factores que mantienen esta variación geográfica no están demasiado claras, y pueden deberse a dos factores; el flujo genético entre poblaciones y la selección recíproca entre las serpientes y las salamandras.
Brodie et al. (2002) encontraron que existen dos evidencias que sugieren que la selección es de gran importancia en la formación de las áreas de máxima coevolución entre la resistencia de las serpientes y la toxicidad de las salamandras. Por un lado, la información filogenética (Janzen et al. 2002) indica que los puntos de máxima resistencia a la TTX (Oregón y California) han evolucionado de forma independiente, lo que podría indicar que esta resistencia ha podido surgir a causa de presiones selectivas similares en dos poblaciones diferentes. Y en segundo lugar, en los lugares donde se cuantificaron los niveles de TTX presentes en la presa, la resistencia y los niveles de toxicidad estaban correlacionados a lo largo de un amplio rango fenotípico y geográfico(Fig 1.). Sin embargo, un estudio más reciente y exhaustivo realizado por Haniffin et al. (2008) muestra que las regiones de correlación entre fenotipos, no necesariamente se corresponden con regiones donde existe una intensa selección recíproca. Según este estudio, las zonas de máxima y mínima coevolución están definidas por la naturaleza de la interacción más que por los niveles de resistencia/toxicidad. Existen puntos de mínima selección reciproca en localidades con fenotipos extremos (máxima/mínima resistencia/toxicidad) tanto en el depredador como en la presa (Fig. 2). De modo similar, la selección reciproca es posible en las localidades previamente señaladas como puntos de mínima coevolución, donde los fenotipos aparecen relacionados entre si a pesar de los bajos niveles de toxicidad de la presa y resistencia del depredador (Fig. 2).
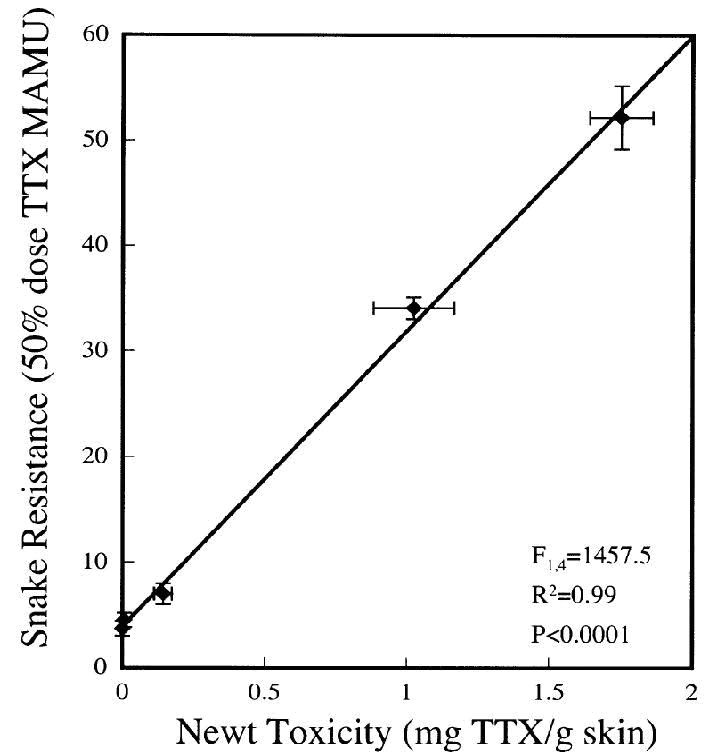
Figura 1. Resistencia a la tetradoxina de las serpientes en 5 poblaciones relativa a la toxicidad de salamandras (mg TTX/ g piel) de las mismas localidades. Como muestra la línea de regresión, en estas localidades la resistencia de T. sirtalis está fuertemente correlacionada con la toxicidad de T. granulosa (Brodie et al., 2002)
Por otro lado, el continuo geográfico observado en los niveles de resistencia a la TTX entre las diferentes poblaciones de T. sirtalis presenta una oportunidad única para explorar los factores que generan los niveles intermedios de resistencia a la TTX. El patrón general de variación gradual desde puntos de máxima resistencia, hasta puntos con resistencia ancestral pasando por los niveles intermedios, es consistente con varios escenarios. Por un lado, este patrón clinal en la resistencia, podría explicarse si la selección varía geográficamente, de puntos donde existen fuertes presiones selectivas a zonas donde es inexistente. Por otro lado, el flujo genético entre las poblaciones de resistencia extrema podría generar y mantener los niveles intermedios.
El uso de una simple explicación para la dinámica clinal observada, flujo genético o selección recíproca, no es aplicable en todos los casos, y ambos factores deben ser tenidos en cuenta en cada caso determinado.
Así, según Brodie et al. (2002) los niveles observados de resistencia y toxicidad en los puntos de máxima resistencia (Oregón y California) están fuertemente correlacionados. Esto implicaría, que existe una fuerte selección entre la toxicidad de las salamandras en estos puntos y la resistencia de las serpientes en cada localidad. En los niveles de resistencia intermedios, esta correlación entre resistencia y toxicidad podría resultar del flujo genético entre poblaciones a distintitos niveles, tanto en las poblaciones de T. granulosa como de T. sirtalis.
Se ha observado que la dinámica coevolutiva en el sistema salamandra-serpiente, pasa por los menos tres estados (Haniffin et al., 2008):
1- Existen localidades con bajos niveles tanto de toxicidad como de resistencia. En algunas de estas localidades, no existe selección recíproca. Todas estas localidades incluyen depredadores capaces de consumir presas sin sufrir efectos mortales, lo que sugiere que si la toxicidad de las salamandras aumenta en estas poblaciones, le podría seguir un aumento de la resistencia por parte de las serpientes.
2- El incremento inicial en la toxicidad puede ser promovido por interacción con otras especies así como con otros elementos del sistema. Algunas localidades como Benton en Oregón en las que se observa una fuerte correlación entre niveles máximos tanto de resistencia como de toxicidad, parecen haber surgido a raíz de un incremento progresivo en estos caracteres. Sin embargo, en otras zonas como Omo en California parecen haber surgido por una aparición repentina de la resistencia extrema a la TTX en las serpientes jarreteras a través de mecanismos genéticos.
3- El siguiente paso para estas poblaciones no parece claro. Si el coste tanto para la resistencia como para la toxicidad es lo suficientemente alto, deberíamos esperar ver poblaciones que pierden sus valores fenotípicos y vuelven a niveles más bajos en sus niveles de resistencia/toxicidad, resultando en una dinámica clinal. Este escenario es plausible y ya ha sido observado en la dinámica coevolutiva química entre algunas orugas y sus plantas hospedadoras. Sin embargo, este proceso no se observa en la coevolución de estas dos especies en la cual no se ven zonas de discordancia con estados intermedios de toxicidad/resistencia.
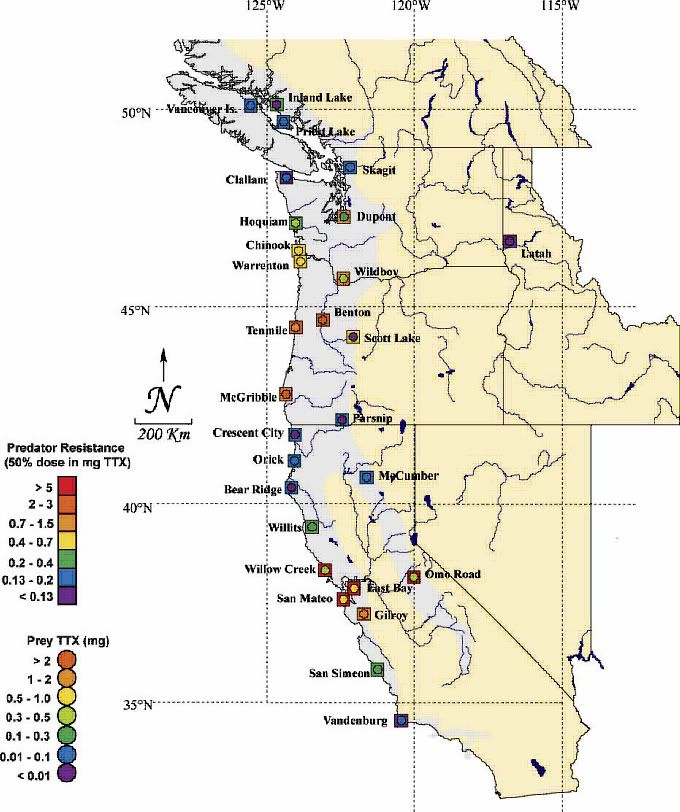
Figura 2. Distribución geográfica de la resistencia de T. sirtalis y la toxicidad de T. granulosa en 28 poblaciones del Oeste de Norte América donde se solapan las poblaciones de ambas especies. Los colores de la leyenda simbolizan la resistencia de las serpientes a la TTX (cuadrados) así como los niveles de TTX (mg) presentes en la presa T. granulossa. El área de distribución del género Taricha se muestra sobre el mapa en color gris, pero se extiende mas allá del mapa hacia el norte a lo largo de la costa de la Columbia Británica hasta el Sureste de Alaska (Haniffin et al. 2008).
PRODUCCIÓN DE TTX EN TARICHA GRANULOSA
Las salamandras del género Taricha poseen tres mecanismos de defensa ante sus depredadores: postura corporal, coloración ventral aposemática y defensa química.

Taricha granulosa en posición “unken reflex”
Los adultos de este género de salamandras, poseen colores dorsales oscuros que les permiten confundirse con su medio, mientras que su vientre es de color naranja brillante. Cuando las salamandras se encuentran con un depredador, adoptan una postura defensiva característica en forma de “U” denominada “unken reflex”, lo que les permite mostrar su coloración ventral para advertir a los depredadores de su toxicidad. Si el depredador no es disuadido, las salamandras deben confiar en sus defensas químicas. Estas salamandras poseen tetrodoxina en concentraciones variable en la piel, ovarios, músculos y en la sangre de los adultos (Lehman et al., 2004). Dentro de este género, T. granulossa presenta los niveles más altos de TTX que se han documentado.
La TTX, es un veneno neurotóxico que se encuentra en un gran número de taxones que incluyen bacterias, dinoflagelados, artrópodos, nemátodos, moluscos, y anfibios (Lehman et al., 2004). Aunque su origen es incierto, se cree que en muchos casos la toxicidad por TTX viene dada por asociaciones simbióticas con bacterias que producen esta toxina como es el caso de algunas especies de pez globo (Takifugu niphobles y Takifugu rubripes), que poseen bacterias productoras de TTX en su tracto digestivo (Matsui et al., 1990; ver en Lehman et al., 2004). Es por esto que, en un inicio algunos autores sugirieron que esta podía ser la causa de la toxicidad en las salamandras del género Taricha (Prince, 1999). Sin embargo, estudios posteriores han mostrado que la TTX en Taricha granulossa es de origen endógeno (Lehman et al., 2004). Este hecho indica que los niveles de TTX presentes en estas especies tienen bases genéticas (Lehman et al., 2004).
Por otro lado, la existencia de salamandras tóxicas y no tóxicas dentro de una misma población puede indicar que la producción de TTX no esta determinada por factores ambientales como ocurre en otros anfibios (por ejemplo en algunas especies de ranas del género Atelopus). Al igual que la resistencia de las serpientes (cuya variación no depende sólo de factores genéticos), existen varios factores como la dieta, ontogenia o estacionalidad que pueden afectar la toxicidad de las salamandras a nivel individual (Lehman et al., 2004). Aún existe un gran desconocimiento sobre las bases genéticas que controlan la producción de TTX en los diferentes taxones que producen esta toxina. Establecer unas bases genéticas de un carácter es un paso importante en el estudio de la evolución ya que este proceso no puede darse sin variaciones hereditarias en los caracteres. Mas investigaciones sobre la genética y heredabilidad de la toxicidad en las salamandras del género Taricha permitirán realizar interpretaciones más exactas de la evolución entre estas salamandras y las serpientes T. sirtalis.
RESISTENCIA A LA TTX
Como ya hemos visto, la coevolución entre Thamnophis sirtalis y su presa, Taricha granulossa, ha resultado en una variabilidad geográfica en los caracteres fisiológicos que dan al depredador la resistencia a la TTX (Geffeney et al. 2005).
Esta neurotoxina, actúa uniéndose a los canales de sodio bloqueando la actividad nerviosa y de las fibras musculares causando parálisis y muerte por asfixia (Fig. 2). Por tanto, el alcance del efecto de la TTX en los tejidos nervioso y muscular, está determinado por la isoforma que estos tejidos presentan de los canales de sodio.
Se ha observado que, los individuos sensibles a la TTX poseen un amino ácido aromático en la estructura del poro que es responsable de la alta afinidad por la TTX (Fig. 2A). Por tanto, la resistencia a la TTX en las serpientes jarreteras puede deberse a un cambio en los genes responsables de la formación de los canales de sodio, o mutaciones de la familia de genes que expresan para los canales de sodio en los miembros sensibles a la TTX.
Geffney et al. (2005) observaron que la elevada resistencia a la TTX ha evolucionado repetidamente en diferentes poblaciones de T. sirtalis a través de una variedad de mutaciones en un grupo de genes responsables de la estructura de los canales de sodio y por tanto, de su afinidad con la TTX. Además, algunos de estos cambios son únicos de determinados linajes confiriendo de esta manera grandes diferencias en la afinidad de los canales de sodio por la TTX y por tanto diferentes grados de resistencia.
Aunque las diferencias en la isoforma de estos canales son la mayor defensa ante la TTX, hay que tener en cuenta que existen otros factores que también contribuyen a la variación observada en la resistencia a la TTX (Geffeney et al. 2002).
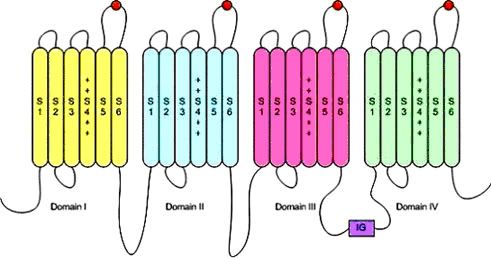
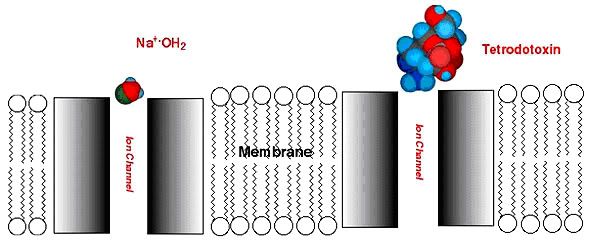
Figura 2. A) Subunidades que conforman los canales de sodio. Los círculos naranjas que conectan S5 con S6, representan los lugares de unión de la TTX con el canal de sodio. B) El gran tamaño de la molécula de TTX hace que el canal quede bloqueado impidiendo el paso de las moléculas de sodio mucho más pequeñas.
Se ha observado que el tamaño corporal se relaciona linealmente con la resistencia a la TTX, al menos entre los juveniles de mayor edad y en los adultos (Ridenhour et al., 1999). La razón de este efecto en la resistencia no está clara del todo, pero puede estar relacionada con un simple efecto de dilución. En los individuos de mayor tamaño, la misma cantidad de toxina constituye una menor concentración, y por tanto, puede reducir el porcentaje de unión de la toxina a los tejidos. En algunos casos, la relación lineal positiva entre tamaño y resistencia puede significar que una salamandra de una toxicidad dada, representa diferente cambio selectivo para serpientes de diferente edad o tamaño.
La interacción entre salamandras y serpientes está mediada también por el comportamiento. Las serpientes pueden de alguna manera valorar su propia resistencia a la TTX y expulsar la presa que es demasiado tóxica para ellas (Williams et al. 2003). Después de capturar a su presa, las serpientes la mantienen sin ingerirla en la boca y en la parte superior del tracto digestivo durante un periodo de tiempo variable. Este comportamiento les permite entrar en contacto con una presa potencialmente mortal sin sufrir consecuencias letales ya que solo las serpientes que poseen una gran resistencia a la TTX pueden consumir las salamandras y sobrevivir. Como resultado, las diferencias en la resistencia a la TTX entre individuos pueden tener consecuencias selectivas para las serpientes. De modo similar, los individuos de salamandras difieren en toxicidad, lo que puede ser resultado de las diferencias en el riesgo de depredación que sufren las diferentes poblaciones. Por esto, que las serpientes puedan valorar su propia resistencia a la TTX representa un mecanismo comportamental por el cual se puede dar selección entre los individuos de T. sirtalis y T. granulossa.
El riesgo asociado con la predación sobre T. granulossa no esta limitado a la muerte por exposición a la TTX. Las serpientes que capturan la salamandra pueden resultar intoxicadas durante un periodo de tiempo que varía de los 23 a los 197 minutos, y este tiempo se alarga hasta 62 minutos mas si la salamandra es ingerida y no es posteriormente expulsada (Williams et al. 2003). Durante este tiempo, las serpientes quedan parcialmente inmovilizadas, corriendo un gran riesgo a ser capturadas por sus depredadores. Aunque el tiempo de exposición a la TTX es la causa principal que influye en el tiempo de recuperación, Brodie et al. (2002) han encontrado que la resistencia de las serpientes a la TTX reduce este periodo. Así, la selección asociada con el tiempo de recuperación puede conducir a la evolución de la resistencia tanto si la secuencia de predación no termina en ingestión.
El comportamiento de expulsión de salamandras demasiado tóxicas, no resulta en una presión selectiva negativa sobre la resistencia. Esto es intuitivo ya que, la variación en la toxicidad de las salamandras y en la resistencia de las serpientes, introduce la posibilidad de que las serpientes puedan encontrarse y consumir salamandras de una toxicidad que está por debajo de su umbral de resistencia en poblaciones donde los niveles de resistencia y toxicidad están correlacionados (Brodie and Brodie, 1990, 1991, 1999a).
El mecanismo por el cual las serpientes valoran su propia resistencia no está claro y podría de hecho ser pasiva. La relación entre tiempo de exposición y resistencia podría existir si las serpientes expulsaran la presa después de haber sufrido alguna vez intoxicación. Por otro lado, la TTX es inicialmente absorbida por las membranas de la boca y parte superior del tracto digestivo provocando adormecimiento de estas zonas (Williams et al., 2002). De este modo, las serpientes poco resistentes podrían sufrir los efectos de la toxina antes que las más resistentes expulsando la presa sin ingerirla.
Existen otros riesgos asociados con alimentarse de estas salamandras, incluyendo el intercambio entre resistencia a la TTX y capacidad locomotora que resultan en que las serpientes mas resistentes son las menos expertas en escapar en caso de ser depredadas (Brodie and Brodie, 1999b). Se ha observado, que tanto a nivel de individuo como poblacional, la velocidad está negativamente asociada con la resistencia ya que las serpientes más rápidas también son las menos resistencias entre las poblaciones (Brodie and Brodie, 1999a). La causa de pérdida de velocidad por parte de las serpientes más resistentes no se conoce, pero puede estar relacionada con las diferencias en la fisiología del músculo esquelético que influyen en la resistencia. Aunque esta pérdida probablemente no influye en la selección debido a la interacción con las salamandras, puede representar una selección opuesta indirecta desde los propios depredadores de la serpiente.
A pesar de los riesgos asociados a consumir estas salamandras, se ha observado que además de poder explotar una presa abundante y que otros depredadores no pueden consumir, esta dieta permite a las serpientes adquirir defensas frente a sus depredadores mediante la acumulación de TTX en sus tejidos (Williams et al., 2004). Debido a la extrema toxicidad de la TTX, y la gran cantidad presente en las salamandras junto con la gran resistencia de Thamnophis sirtalis a esta toxina, cabe la posibilidad de que las serpientes puedan almacenar concentraciones variables de TTX en sus propios tejidos después de haber ingerido a su presa. Este mecanismo de defensa frente a depredadores ya ha sido explotado por otros organismos, como las ranas Dendrobates y Mantellinae (Daly et al., 1997; Saporito et al., 2003), que adquieren su toxicidad de elementos obtenidos a través de su dieta. También se ha observado en un género de serpientes natricidas (Rhabdophis), estrechamente relacionada con el genero Thamnophis. Este género de serpientes, contiene varias especies que adquieren toxinas de su presa (sapos del genero Bufo), las cuales son secuestradas por glándulas nucales (Akizawa et al., 1985).
La existencia de TTX en el hígado de las serpientes jarreteras en cantidades variables hace que algunas serpientes de estas poblaciones se vuelvan ponzoñosas para sus depredadores potenciales (Williams et al., 2004). El nivel de toxicidad que adquieren las serpientes depende de la variación en la toxicidad de las salamandras así como de las diferencias individuales en la propia susceptibilidad de las serpientes a la TTX. Una sola salamandra dota de toxicidad a las serpientes durante un periodo de 3-4 semanas después de haber sido consumida (Williams et al. 2004). La posibilidad de que algunas poblaciones de serpientes jarreteras puedan emplear la TTX obtenida de su dieta como mecanismo de defensa añade otra dimensión a la interacción coevolutiva entre T. sirtalis y T. granulosa que debe ser explorada.
CONCLUSIONES
1- La coevolución entre T. sirtalis y T. granulossa se manifiesta en una variación geográfica en los niveles de toxicidad (niveles de TTX) de la presa y de resistencia del depredador a la toxina. Aunque el patrón geográfico observado en la coevolución entre la toxicidad de T. granulosa y la resistencia de T. sirtalis, sigue una dinámica clinal en la mayoría de los casos, en algunas localidades las serpientes han conseguido escapar de este patrón desarrollando una resistencia mucho mayor de la que es necesaria para consumir las salamandras locales. Estos datos sugieren que existe una variación geográfica en la selección coevolutiva de estas especies.
2- Aunque se ha observado que la variación en la toxicidad de T.granulossa guarda relación con de T. sirtalis, las bases genéticas de la variación en los niveles de TTX presentes en esta salamandra aún no han sido estudiados. Esto se refleja en que gran parte de la literatura sobre la coevolución de estas dos especies se centra en la respuesta del depredador a la toxicidad de su presa.
3- La resistencia a la TTX de T. sirtalis permite a esta serpiente explotar una presa abundante que otros depredadores no pueden consumir. A pesar de que quizás los factores fisiológicos y genéticos que se manifiestan en diferencias en la isoforma de los canales de sodio son la defensa más importante frente a la TTX, la resistencia es una mezcla de factores fisiológicos, morfológicos y comportamentales.
4- La existencia de niveles variables de TTX en los tejidos de T.sirtalis tras cuatro semanas después de haber ingerido a su presa, indican que al igual que otras serpientes cercanamente emparentadas con ellas, son capaces de aprovechar las toxinas de su presa como defensa ante sus propios depredadores.
BIBLIOGRAFÍA
Akizawa, T., Yasuhara, T., Kano, R., and Nakajima, T. 1985. Novel polyhydroxylated cardiac steroids in the nuchal glands of the snake, Rhabdophis tigrinus. Biomed. Res. 6: 437–441.
Brodie, E. D. Jr., Ridenhour, B. J., Brodie, E. D. III 2002. The evolutionary response of predators to dangerous prey: hotspots and coldspots in the geographic mosaic of coevolution between garter snakes and newts. Evolution, 56: 2067–2082.
Brodie, E. D., III and Brodie, E. D., Jr. 1990. Tetrodotoxin resistance in garter snakes: an evolutionary response of predators to dangerous prey. Evolution, 44: 461-469.
Brodie, E. D., III and Brodie, E. D., Jr. 1991. Evolutionary response of predator to dangerous prey: reduction of toxicity of newts and resistance of garter snakes in island populations. Evolution, 45: 221-224.
Brodie, E. D., III and Brodie, E. D., Jr. 1999a. Predator-prey arms races. Biosciences, 49: 557-568.
Brodie, E. D., III and Brodie, E. D., Jr. 1999b. The cost of exploiting poisonous prey: evolutionary tradeoffs in a predator-prey arms race. Evolution, 53: 626-631.
Daly, J. W., Garraffo, H. M., Hall, G. S. E., and Cover, J. F. 1997. Absence of skin alkaloids in captive-raised Madagascan mantelline frogs (Mantella) and sequestration of dietary alkaloids. Toxicon, 35:1131–1135.
Duellman, W. E., and Trueb, L. 1986. Biology of the Amphibians. McGraw–Hill Book, New York.
Geffeney, S. L., Fujimoto, E., Brodie, E. D. III, Brodie, E. D. Jr., and Ruben, C. P., 2005. Evolutionary diversification of TTX-resistant sodium channels in a predator-prey interaction. Nature, 434: 759-762.
Geffeney, S., Ruben, P. C. Brodie, E. D. Jr., and Brodie, E. D. III. 2002. Mechanisms of adaptation in a predator-prey arms race: TTX resistant sodium channels. Science, 297: 1336–1339.
Hanifin, C. T., Brodie, E. D., Jr., Brodie, E. D. III 2008. Phenotipic mismatches reveal escape from arms-race coevolution. Plos Biology, 6(3): 471-482.
Hochberg, M. E; Van Baalen, M. 1998. Antagonistic coevolution over productivity gradients. American Naturalist 152: 620-634.
Janzen, F. J., Krenz, J. G., Haselkorn, T. S., Brodie, E. D. Jr., and Brodie, E. D. III. 2002. Molecular phylogeography of common garter snakes (Thamnophis Sirtalis) in western north america: Implications for regional forces. Molecular Ecology, 11:1739–1751.
Lehman, E. M., Brodie, E. D., Jr., and Brodie, E. D., III, 2004. No evidence for an endosymbiotic bacterial origin of tetrodotoxin in the newt Taricha granulosa. Toxicon, 44(3): 243-249.
Mosher, H. S., Fuhrman F. A., Buchwald H. D., and Fischer H. G. 1964. Tarichatoxin tetrodotoxin: a potent neurotoxin. Science, 144:1100–1110.
Motychak, J. E., Brodie, E. D. Jr., and Brodie, E. D. III (1999). "Evolutionary response of predators to dangerous prey: Preadaptation and the evolution of tetrodotoxin resistance in garter snakes." Evolution, 53, 1528-1535.
Myers, C. W., Daly, J. W., and Malkin, B. 1978. A dangerously toxic new frog (Phyllobates) used by Ember´a Indians of western Columbia, with discussion of blow gun fabrication and dart poisoning. Bull. Am. Mus. Nat. Hist. 161:307–365.
Prince, R. C. 1999. The arms suppliers in predator-prey arms races. Biosciences, 49(12): 944.
Rausher, Mark D. 2001. Co-evolution and plant resistance to natural enemies. Nature 411: 857-862
Ridenhour, B. J., Brodie E. D. Jr, and Brodie E. D. III. 1999. Effects of repeated injection of tetrodotoxin on growth and resistance to tetrodotoxin in the garter snake Thamnophis sirtalis. Copeia, 1999:531–535.
Saporito, R. A., Donnelly, M. A., Hoffman, R. L., Garraffo, H. M., and Daly, J. W. 2003. A siphonotid millipede (Rhinotus) as the source of spiropyrrolizidine oximes of dendrobatid frogs. Journal of Chemical Ecolgy, 29:2781–2786.
Simms, E. L. 1996. The evolutionary genetics of plant-pathogen systems. Bioscience 46: 136-143.
Smith, H. M. and White, F. N. 1955. Adrenal enlargement and its significance in the Hognose snakes (Heterodon). Herpetologica 11:137–144.
Williams, B. L., Brodie, E. D., Jr., and Brodie, E. D., III. 2002. Comparisons between toxic effects of tetrodotoxin administered orally and by intraperitoneal injection to the garter snake Thamnophis sirtalis. Journal of Herpetology, 36:112–115.
Williams, B. L., Brodie, E. D., Jr., and Brodie, E. D., III. 2003. Coevolution of deadly toxins and predator resistance: Self-assessment of resistance by garter snakes leads to behavioral rejection of toxic newt prey. Herpetologica 59:155–163.
Williams, B. L., Brodie, E. D., Jr., and Brodie, E. D., III. 2004. A resistant predator and its toxic prey: persistence of newt toxin leads to poisonous (not venomous) snakes. Journal of Chemical Ecology, 30(10): 1901-1919.
Artículo de Goirod & Rovi, para Tuatera.com. Este artículo ha sido cedido por sus autores para su uso y difusión únicamente en tuatera.com. Este artículo esta protegido por las leyes intelectuales y de derechos de autor. No obstante puedes utilizarlo en medios online NO IMPRESOS y siempre y cuando sea para fines sin ánimo de lucro, siempre que no se cambie, ni resuma, ni modifique en forma alguna su contenido y siempre que se haga referencia a esta dirección web www.tuatera.com y a sus autores, Goirod & Rovi. Las imágenes no son de los autores.
Toda la información sobre reptiles en Tuatera.com
No hay comentarios:
Publicar un comentario